O mesotelioma deciduóide é um subtipo raro de mesotelioma epitelióide, inicialmente encontrado apenas no peritoneu de mulheres jovens, sem relação com exposição a asbestos. No entanto, desde as primeiras descrições tem sido igualmente diagnosticado na pleura e no pericárdio e pode estar associado aos asbestos. De um modo geral, tem pior prognóstico quando comparado com o mesotelioma epitelióide. Há apenas 45 casos descritos na literatura até à data, 22 destes localizados na cavidade pleural. Os autores descrevem um caso de mesotelioma deciduóide pleural numa mulher de 40 anos com toracalgia pleurítica direita, sem história de exposição aos asbestos, submetida a quimioterapia seguida de ressecção cirúrgica, que veio a falecer no pós-operatório.
Deciduoid Mesothelioma is a rare variant of epithelioid mesothelioma; it was initially thought that it only occurred in the peritoneum of young women and had nothing to do with asbestos exposure. However, since these early findings it has also been observed in the pleura and the pericardium, with possible association to asbestos. In general the prognosis is poor compared to epithelioid mesothelioma. 45 cases have been reported in the literature up to now, 22 of these were located in the pleural cavity. The authors describe a case of deciduoid pleural mesothelioma in a 40-year-old-woman who presented with right pleuritic chest pain, with no history of asbestos exposure, treated with chemotherapy followed by surgery and who died postoperatively.
O mesotelioma maligno é o tumor maligno primário da pleura mais comum e a sua incidência tem vindo a aumentar nos Estados Unidos, na Europa, no Japão e na Austrália. Há quatro subtipos histológicos principais – epitelióide, sarcomatóide, desmoplásico e bifásico.
O mesotelioma deciduóide, uma variante rara do mesotelioma epitelióide, foi descrito pela primeira vez por Talerman et al.1 em 1985 e Nascimento et al.2 em 1994 no peritoneu de mulheres jovens, tendo sido inicialmente considerado restrito a este grupo de doentes.
No entanto, desde essa altura têm sido descritos casos deste tipo de tumor em homens, mulheres mais velhas e também a nível da pleura e do pericárdio. Apesar de ter sido considerado inicialmente não relacionado com a exposição aos asbestos, foram já relatados vários casos relacionados com esta exposição. Em 2000, foram descritos os primeiros casos de mesotelioma deciduóide pleural3, tendo sido referenciados até à data 22 casos deste tipo de tumor na cavidade pleural4.
Os autores descrevem um caso clínico de mesotelioma deciduóide pleural numa mulher de 40 anos sem história de exposição aos asbestos.
Caso clínicoUma mulher de 40 anos, previamente saudável, não fumadora, referia toracalgia pleurítica direita com um mês e meio de evolução, sem outra sintomatologia e sem melhoria com terapêutica analgésica e antibiótica. A telerradiografia do tórax pedida pelo médico assistente evidenciou hipotransparência homogénea no terço inferior do hemitórax direito e oclusão do seio costofrénico, compatível com derrame pleural, tendo por isso sido enviada ao Serviço de Urgência dos Hospitais da Universidade de Coimbra. Dos antecedentes pessoais, há a referir uma cesariana 2 semanas antes do início da toracalgia. A doente não tinha hábitos medicamentosos nem história ocupacional de risco, incluindo exposição a asbestos (trabalhava como secretária em Repartição Pública). Não tinha igualmente história familiar de neoplasia.
Ao exame objetivo, apresentava-se febril (38°C), sem sinais de dificuldade respiratória e o exame torácico evidenciava diminuição do murmúrio vesicular no terço inferior do hemitórax direito, macicez à percussão e diminuição da transmissão das vibrações vocais a este nível.
A gasometria arterial apresentou pH 7,45; PaO2 78mmHg; PaCO2 37mmHg; SatO2 96%. Os exames laboratoriais evidenciaram anemia normocrómica normocítica (hemoglobina 11,9g/dL; limites de referência 12-15g/dL), trombocitose (742 x109 plaquetas/L; limites de referência 150-400 x109 plaquetas/L), leucocitose (10,9 x109 células/L; limites de referência 4-10 x109 células/L), coagulação alterada, elevação da proteína C-reativa (19,77mg/dL; limites de referência 0-0,5mg/dL) e das enzimas hepáticas. A telerradiografia do tórax realizada no Serviço de Urgência evidenciou agravamento radiológico e progressão do derrame pleural, que ocupava nesta fase o terço inferior do hemitórax direito. A doente foi internada no Serviço de Pneumologia tendo sido efetuada toracocentese diagnóstica. Ao 5.° dia de internamento foi colocado tubo de drenagem torácica na cavidade pleural direita, por agravamento do derrame pleural, que ocupava nesta altura mais de metade do hemitórax direito. Macroscopicamente, o líquido pleural era seroso e as análises subsequentes mostraram um predomínio de neutrófilos (44%) com 38% de linfócitos, exame cultural negativo, pH de 7,71, adenosina desaminase baixa (15,5 U/L), LDH elevada (1.359 U/L) e citologia negativa para células tumorais. Foram drenados 2.500 cc de líquido pleural durante 9 dias.
As hemoculturas e a pesquisa urinária de antigénios de S. pneumonia e do serogrupo 1da Legionella pneumophila foram negativos. Os marcadores tumorais CYFRA 21.1, SCC, CA 125 e CA 15.3 encontravam-se elevados.
A tomografia computorizada (TC) do tórax mostrou áreas de densificação parenquimatosa inflamatória com broncograma aéreo no lobo superior direito, lobo médio e lobo inferior esquerdo, adenopatias hilares direitas, derrame pleural direito organizado e lesão nodular com 5,8 X 3,3cm no sulco costofrénico direito que invadia a 8.ª costela e a parede torácica, com origem pleural.
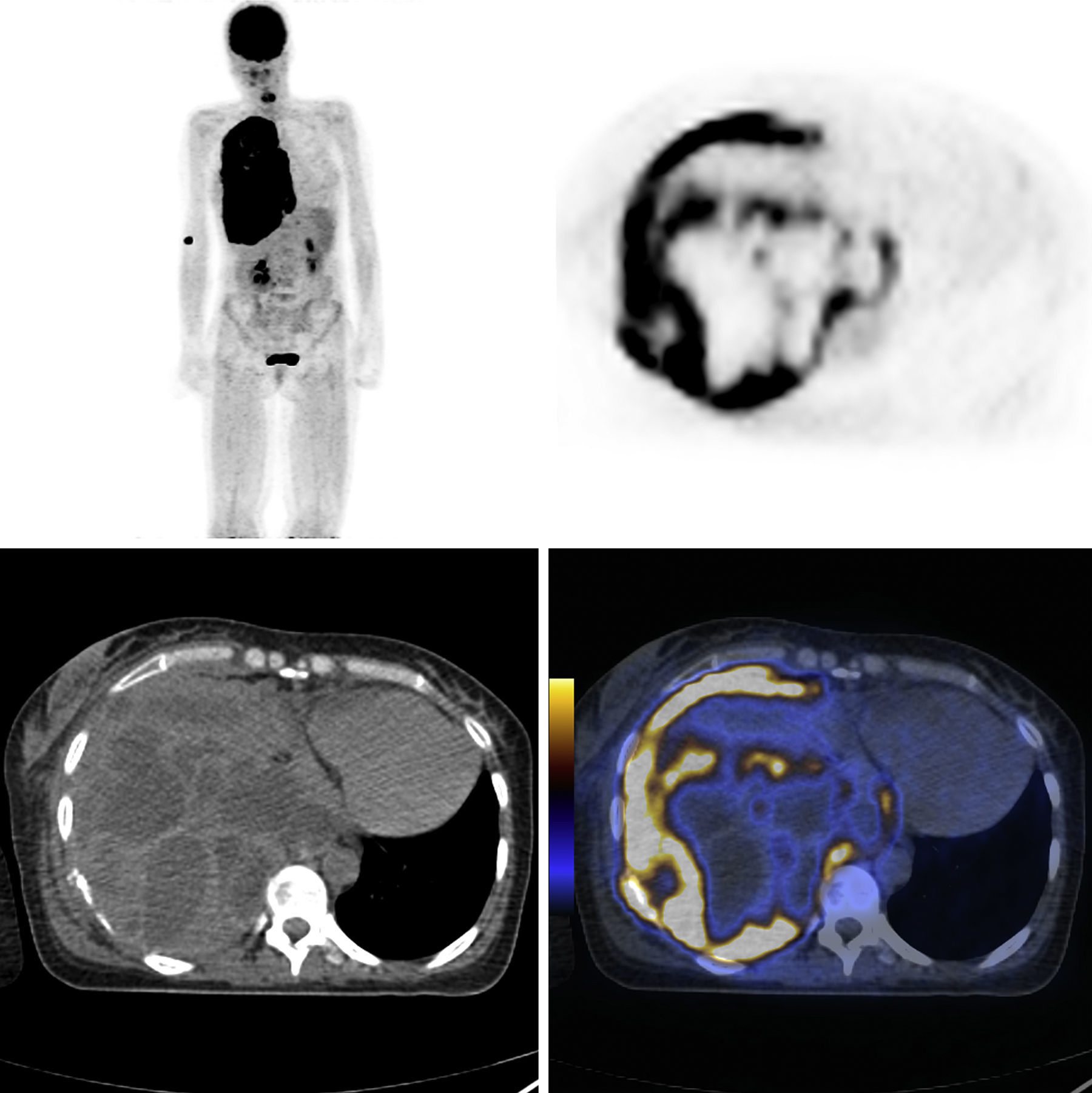
A broncofibroscopia não evidenciou alterações endobrônquicas e os exames culturais do aspirado traqueo-brônquico foram negativos. A ecografia abdominal era normal. A tomografia por emissão de positrões/tomografia computorizada (Positron emission tomography/computed tomography - PET/CT) demonstrou extenso envolvimento hipermetabólico da pleura direita suspeito de envolvimento neoplásico maligno, uma massa na porção postero-inferior que invadia a parede torácica adjacente (SUV - standardized uptake value médio e máximo de 15 e 22, respetivamente), derrame pleural homolateral suspeito de derrame de origem neoplásica e envolvimento ganglionar secundário mediastínico e bronco-hilar direito (fig. 1).
PET/CT. Extenso envolvimento hipermetabólico da pleura direita suspeito de envolvimento neoplásico maligno, uma massa na porção postero-inferior que invadia a parede torácica adjacente, derrame pleural homolateral suspeito de derrame de origem neoplásica e envolvimento ganglionar secundário mediastínico e bronco-hilar direito.
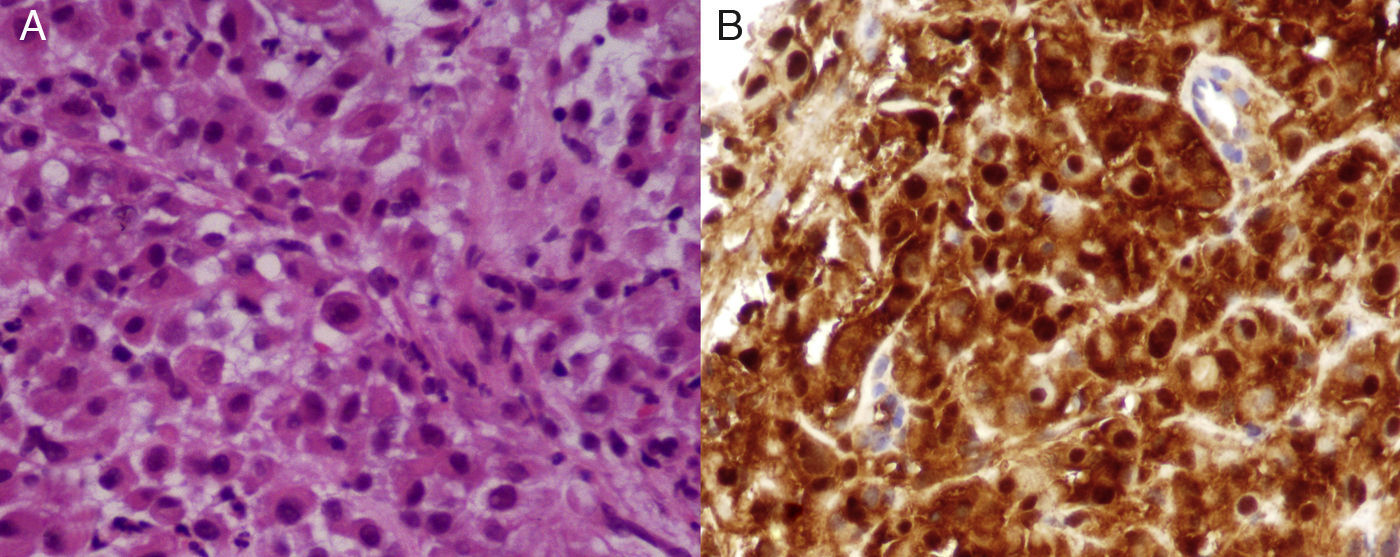
Foi efetuada biopsia transtorácica da massa pleural, evidenciando o exame anatomopatológico células epitelióides malignas, grandes e descoesas, com citoplasma eosinófilo e núcleos grandes redondos (fig. 2A). Estas células mostravam positividade citoplasmática para citoqueratina 7, bem como positividade citoplasmática e nuclear para calretinina (fig. 2B) e positividade nuclear para p53. Assim, foi feito o diagnóstico de mesotelioma deciduóide pleural. O estadiamento, de acordo com o International Mesothelioma Interest Group (IMIG)5 era T3 N2 M0 (Estadio III).
A doente iniciou quimioterapia com cisplatina e pemetrexed, tendo sido realizada PET/CT para reavaliação ao fim de 3 ciclos de quimioterapia, que mostrou envolvimento progressivo da parede torácica, mas sem metástases extra-torácicas. A doente foi aceite para cirurgia radical, que incluiu pneumonectomia extra-pleural direita com ressecção dos 5.°, 7.° e 8.° arcos costais. O diagnóstico histológico foi confirmado morfologicamente na peça operatória, após observação de múltiplas secções de tumor amarelecido a envolver o pulmão, mantendo o padrão previamente observado. A doente morreu no 2.° dia do pós-operatório, de falência multi-orgânica, 3 meses após o diagnóstico inicial.
DiscussãoO mesotelioma maligno deciduóide é uma variante rara do mesotelioma epitelióide, correspondendo a menos de 5% dos mesoteliomas6 e a menos de 2% de acordo com outro autor7. Talerman et al.1 em 1985 foram os primeiros a descrever os aspetos deciduóides do mesotelioma maligno no peritoneu de uma jovem de 13 anos. Em 1994, Nascimento et al.2 descreveram um caso de lesão peritoneal numa mulher jovem, com características morfológicas semelhantes às descritas por Talerman, designando-a de mesotelioma deciduóide. Inicialmente, esta entidade era considerada restrita ao peritoneu de mulheres jovens sem história de exposição aos asbestos. No entanto, as descrições posteriores mostraram igualmente a sua presença na pleura e no pericárdio de doentes mais velhos, de ambos os sexos, e por vezes associado à exposição aos asbestos. No caso descrito a doente não tinha história de exposição aos asbestos.
Foram descritos alguns casos de mesotelioma maligno deciduóide, quer na pleura quer no peritoneu, diagnosticados durante a gravidez2,8 e também um caso no peritoneu de uma mulher 6 semanas após uma cesariana9, erroneamente interpretado como deciduose pseudotumoral. O presente caso ocorreu também 2 semanas após uma cesariana. É, no entanto, difícil estabelecer uma relação entre as hormonas sexuais e as características deciduóides.
Estão descritos na literatura apenas 45 casos de mesotelioma deciduóide, com idades entre 13 e 78 anos (média de 51 anos), 22 dos quais na cavidade pleural4. Vinte e seis dos 45 casos foram descritos em mulheres. A exposição aos asbestos foi documentada apenas em 15 casos, com média de idade de início de 59,1 anos, diferente de 47,7 anos dos doentes sem exposição documentada aos asbestos.
Esta variante do mesotelioma epitelióide caracteriza-se pela sua morfologia típica, com proliferação de grandes células redondas, citoplasma eosinófilo abundante, características deciduóides e núcleos vesiculares redondos9. A imuno-histoquímica é útil na diferenciação entre mesotelioma e adenocarcinoma10. No caso descrito, o mesotelioma deciduóide expressava calretinina de modo evidente.
É importante realçar algumas características descritas nos doentes com mesotelioma deciduóide. É semelhante o número de casos descritos na pleura e no peritoneu, ao contrário do mesotelioma em geral, 4 vezes mais comum na pleura11. Verifica-se um predomínio do sexo feminino no mesotelioma deciduóide, que difere do ligeiro predomínio no sexo masculino no mesotelioma em geral. É significativo o número de doentes jovens (< 40 anos) nesta variante do mesotelioma, como também se verificou na doente referida, o que contrasta com a idade mais avançada dos doentes com mesotelioma em geral. Outra característica é a baixa percentagem de exposição aos asbestos no mesotelioma deciduóide. Todas estas diferenças sugerem que o mesotelioma deciduóide possa ser uma variante clínica e patológica distinta6.
A melhor opção terapêutica no mesotelioma continua a ser tema de debate e um desafio. Vários estudos descreveram bons resultados com a pneumonectomia extra-pleural associada a quimioterapia neo-adjuvante ou adjuvante12–15. No entanto, terá sido sobrestimado o benefício desta terapêutica multimodal e deve ter-se em atenção que a pneumonectomia extra-pleural é um procedimento complexo, associado a elevada morbilidade e mortalidade, inclusive no período peri-operatório, como no caso que descrevemos. De facto, alguns estudos retrospetivos sugerem que a pneumonectomia extra-pleural não oferece vantagens em relação a procedimentos menos radicais, como a pleurectomia e a descorticação16–20, eficazes como medidas paliativas. Tem sido sugerida a realização de radioterapia hemitorácica, após pneumonectomia extra-pleural, mas é necessária avaliação posterior para melhor definir o seu papel. As terapêuticas intrapleurais ou locais, como terapêutica fotodinâmica, quimioterapia intrapleural hipertérmica e imunoterapia, foram estudadas para tratar a doença residual microscópica que permanecia após a cirurgia. No entanto, todas estas modalidades necessitam de mais avaliação. Estudos randomizados demonstraram que a quimioterapia sistémica é a única modalidade terapêutica que aumenta a sobrevida.
A nossa doente iniciou cisplatina e pemetrexed, a terapêutica standard do mesotelioma sistémico, seguida de ressecção cirúrgica, tendo falecido no pós-operatório. A causa da morte não foi esclarecida.
O mesotelioma maligno deciduóide tem habitualmente mau prognóstico e 68% dos doentes morrem no primeiro ano após iniciar terapêutica4. No entanto, há casos descritos de doentes com mesotelioma deciduóide com sobrevida mais longa5,8, desafiando a inevitabilidade de um mau prognóstico21. São necessários mais estudos e mais casos clínicos para melhor esclarecer esta entidade.
Em suma, descrevemos um caso de mesotelioma deciduóide da pleura numa mulher de 40 anos, com apresentação clínica 2 semanas após uma cesariana, sem exposição conhecida aos asbestos. Salientamos a raridade desta variante, o facto de ser o primeiro caso descrito em Portugal, o papel da patologia no estabelecimento do diagnóstico, as características que distinguem o mesotelioma deciduóide do mesotelioma em geral e as várias opções terapêuticas disponíveis.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Os autores agradecem a Jessica Cemlyn Jones pela revisão linguística.