Devido à inadequada resposta aos corticóides inalatórios, os pacientes com asma de difícil controlo (ADC) são submetidos a corticóides orais ou uso de omalizumabe. Embora sejam necessários para o tratamento desses pacientes, há uma relação significativa entre o uso de esteróides e fraqueza muscular periférica e respiratória, resultando em implicações como a perda da qualidade de vida e função pulmonar comprometida. No entanto, não se sabe se estes pacientes sofrem alterações neurofisiológicas devido ao efeito da droga.
ObjetivoInvestigar as características neurofisiológicas e funcionais de pacientes com ADC, para melhor compreensão da doença.
MétodoFoi realizado um estudo transversal em 3 grupos de pacientes: ADCC (que fazem uso de corticóide por via oral); ADCO (que fazem uso do Omalizumab) e GC (controlo saudável da mesma idade). A avaliação foi composta pela prova da marcha dos 6 minutos, teste senta-levanta, equilíbrio estático com a plataforma de pressão, reflexos monossimpáticos (patelar e aquileu) e a força do quadríceps do membro inferior dominante.
ResultadosEmbora os resultados em relação aos aspetos neurofisiológicos mostrem não haver diferença estatisticamente significativa entre os grupos controlo e com ADC, deve ser observado que o grupo com ADC, apresentou importante redução da capacidade funcional, quando comparado ao grupo controlo (diminuição da força muscular (p<0,05), diminuição da distância percorrida no teste da caminhada (p<0,05) e diminuição do número de repetições no teste senta/levanta (p<0,05).
ConclusãoIndivíduos com ADC apresentaram redução da capacidade funcional. O grupo ADCC também demonstrou redução na força muscular quando comparado ao grupo controlo, provavelmente causado pelo uso contínuo de corticóides. No entanto, nenhuma alteração neurofisiológica foi encontrada na população estudada.
Due to the inadequate response to inhaled corticoids, patients with difficult-to-control asthma (DCA) are submitted to oral corticoids or use of Omalizumab. Although it is necessary to treat these patients, a significant relationship between steroid usage and both peripheral and respiratory weakness muscle, results in implications such as loss of quality of life and compromised lung function. Nonetheless, it is not known whether these patients suffer neurophysiological changes due to drug effect.
ObjectiveTo investigate the neurophysiological and functional characteristics of patients with DCA in order to gain a better understanding of the condition.
MethodA cross-sectional study was carried out involving three groups of patients: DCA-C (use of oral corticosteroids), DCA-O (use of omalizumab) and CG (healthy controls matched for age). The assessment involved the six-minute walk test, sit-to-stand test, static balance on a pressure platform, patellar and Achilles reflexes and quadriceps strength in the dominant leg.
ResultsThe results revealed no statistically significant differences between the control group and DCA groups in relation to neurophysiological aspects. However, the DCA groups exhibited a significant reduction in functional capacity [decreased muscle strength (p < 0.05), shorter distance covered on walk test (p < 0.05) and lesser number of repetitions on sit-to-stand test (p < 0.05)] in comparison to the control group.
ConclusionIndividuals with DCA exhibited a reduction in functional capacity. The DCA-C group also demonstrated a reduction in muscle strength when compared with control group, likely caused by the continual use of corticoids. However, no neurophysiological alterations were found in the studied population.
A asma é uma doença inflamatória crônica caracterizada por hipereactividade das vias aéreas inferiores e por limitação variável ao fluxo aéreo1–3, que normalmente responde ao tratamento com corticóides inalatórios (com ou sem a adição de beta agonistas de ação prolongada ou de outros medicamentos), diminuindo a inflamação, a obstrução e a hipereactividade das vias aéreas. No entanto, cerca de 5 a 10% dos pacientes não apresentam reversibilidade total dos sintomas. Asma grave ou asma de difícil controlo (ADC) é o termo utilizado quando a asma é insuficientemente controlada por mais de 6 meses, apesar de uma estratégia terapêutica adequada indicada por um especialista e ajustada ao nível de gravidade clínica4–6.
Por não responderem adequadamente ao uso de corticóides inalatórios, os portadores de ADC são submetidos ao tratamento com corticóides via oral (ou sistémico) cuja ação principal é a inibição do recrutamento de células inflamatórias e inibição da libertação de mediadores pró-inflamatórios e citocinas, ativados no processo inflamatório e nas células epiteliais das vias aéreas6. Outra opção é a utilização de Omalizumabe, um anticorpo anti-IgE, que funciona impedindo a ligação do IgE ao recetor de alta afinidade existente em mastócitos e basófilos, desde a fase inicial da resposta alérgica, e bloqueia a ligação de imunoglobulina ao recetor de baixa afinidade existente em linfócitos B e em vários tipos celulares7–12.Embora sejam necessários para o tratamento desses pacientes, uma relação significativa entre a utilização de esteróides e fraqueza muscular periférica e respiratória tem sido relatada na doença pulmonar crônica13 e na fibrose cística14, porque, no músculo esquelético, os corticóides diminuem a taxa de síntese de proteínas e aumentam a taxa da degradação de proteínas contribuindo para a atrofia15–18. A fraqueza de músculos periféricos e respiratórios podem ter importantes implicações clínicas, como a perda da qualidade de vida, fadiga, menor eficácia na cicatrização das feridas, função pulmonar comprometida e resposta imune mais pobre. No entanto, não se sabe se estes pacientes sofrem alterações neurofisiológicos devido ao efeito do fármaco, por isso, é importante investigar as alterações neurológicas e funcionais em indivíduos com ADC com a utilização de corticóides ou omalizumabe, a fim de se estabelecer uma intervenção terapêutica melhor dirigida.Portanto, o objetivo do presente estudo foi investigar as características neurofisiológicas e funcionais de pacientes com ADC, para melhor compreensão da doença e processos de monitorização na reabilitação pulmonar desses indivíduos.
Material e métodosCasuísticaUm estudo transversal foi realizado no Laboratório de Biodinâmica do Movimento Humano da Universidade Nove de Julho (UNINOVE). Os pacientes foram recrutados no Ambulatório de Asma de Difícil Controlo (ADC).
Os critérios de inclusão estabelecidos foram: idade compreendida entre 40 a 60 anos, ter diagnóstico de ADC, com histórico de sintomas diários (tosse, dispneia, aperto no peito e sibilância), despertares noturnos, contínua limitação de atividades, exacerbações frequentes, VEMS < 80% do melhor valor apresentado pelo paciente, que se apresentaram controlados ou parcialmente controlados no momento da avaliação. Foram excluídos indivíduos que realizassem exercícios físicos regularmente (periodicidade contínua e maior ou igual a três vezes por semana), fumadores, pacientes com ADC não controlada e pacientes envolvidos em programas de reabilitação pulmonar.
Os pacientes foram divididos em 2 grupos: os que faziam uso de corticóide por via oral (ADCC - 12 indivíduos) e os que faziam uso do Omalizumab (ADCO – 6 indivíduos). Um terceiro grupo, composto por 11 indivíduos saudáveis, constituiu o grupo controlo (GC) que, como critérios de inclusão, não poderiam apresentar doenças pulmonares, ser fumadores ou ex-fumadores e não praticar exercícios físicos regulares, avaliados por meio do International Physical Activity Questionnaire-short form (IPAQ), sendo recrutados indivíduos classificados como insuficientemente ativos (não realizam qualquer atividade física, ou exercem atividade física, mas não é suficiente para ser classificada como intensidade moderada ou elevada).
Todos os participantes assinaram o termo de consentimento livre e esclarecido e foram informados da possibilidade de se retirarem da pesquisa em qualquer fase, sem penalização. Essa pesquisa foi analisada e aprovada pelo Comité de Ética da Irmandade da Santa Casa De Misericórdia de São Paulo (protocolo n° 334/09). Ao finalizar a fase informativa (Termo de Consentimento), foi dada orientação sobre as atividades a serem executadas durante a recolha dos dados, bem como da finalidade do trabalho.
ProcedimentosAvaliação eletromiográficaOs componentes do sistema de aquisição de sinais (elétrodos e célula de carga) foram conectados a um módulo condicionador de sinais, onde os sinais analógicos, amplificados em 10 vezes foram amplificados novamente, com um ganho de 100 vezes, totalizando, portanto, um ganho final de 1000, e filtrados com filtro passa banda de 10Hz a 500Hz. Dois pares de elétrodos de superfície do tipo ativo, bipolar, diferencial e razão do modo comum de rejeição igual a 80dB, foram colocados sobre o ponto motor dos músculos reto femoral (RF) e sóleo (SO), conforme recomendações do Projeto SENIAM19.
O sinal eletromiográfico foi recolhido durante o teste de reflexo monossináptico, realizado por meio do martelo de exame neurológico adaptado com um switch na sua área de percussão. Para o reflexo patelar o paciente teve de se manter sentado com as pernas pendentes e o tendão patelar percutido com um golpe curto e rápido, observando-se a extensão do joelho; já para o reflexo aquileu, o paciente teve de se manter em decúbito ventral com os pés pendentes para fora da maca, e o seu tendão de Aquiles levemente tensionado por meio de uma discreta dorsiflexão passiva do pé, para testá-lo, o tendão foi percutido induzindo uma flexão plantar involuntária20.
Avaliação da força muscularO paciente sentado realizou extensão do joelho sob resistência na sua capacidade máxima de força, ou seja, o pico de força da contração isométrica do quadríceps dominante e os dados foram recolhidos por meio da célula de carga em Kg/força acoplada ao modulo condicionador de sinais da eletromiografia21.
Avaliação do equilíbrio estáticoFoi utilizada a plataforma de força da marca TekScan, modelo MatScan (0,50X0,60cm), onde as oscilações dos pontos de força em relação a velocidade e ao deslocamento ântero-posterior e latero-lateral foram analisadas, permitindo avaliar o equilíbrio por meio do COF (centro oscilatório de força), que nada mais é que uma resultante dessas duas variáveis. Este sistema de mensuração contém 2288 sensores de força, arranjados nas fileiras e colunas da plataforma, conectados a um sistema de aquisição dos dados controlado pelo software Research Foot 5.60da TekScan, para armazenamento e interpretação dos mesmos pelo computador.
Foi solicitado que cada paciente permanecesse estático na plataforma mantendo uma distância entre os pés similar à distância dos ombros. Após a calibração do sistema, de acordo com o peso corporal do paciente, permaneceram parados na posição bípede por 60 segundos, com a cabeça alinhada, focalizando um ponto específico na parede na altura dos olhos de cada paciente e sem falar22.
Teste Senta-LevantaPara realização deste teste foi utilizado uma cadeira padrão (altura 46cm) sem os descansos do braço. Após demonstração foi solicitado que iniciasse o movimento, levantando e sentando da cadeira sem o apoio das mãos, repetindo o procedimento tantas vezes quanto possível no período de 1 minuto a uma velocidade definida por eles próprios e que os fizesse sentirem-se seguros e confortáveis. O número de repetições foi registado23.
Prova da Marcha dos 6 minutosO teste foi realizado num corredor com comprimento de 30 metros e livre de circulação de pessoas, o paciente foi instruído a caminhar o mais rápido que conseguisse no período de 6 minutos. Durante a realização do teste, foram utilizadas a cada minuto frases de encorajamento, padronizadas. A distância percorrida foi registada24.
Análise estatísticaFoi aplicado o teste de Shapiro-Wilk e observou-se distribuição normal para todos os dados. Como os dados foram paramétricos, One-Way Anova foi utilizado para comparar a média dos dados entre os três grupos e o teste de comparação múltipla de médias DHS de Tukey na presença de significância para análise entre postos. O nível de significância adotado foi de 5%.
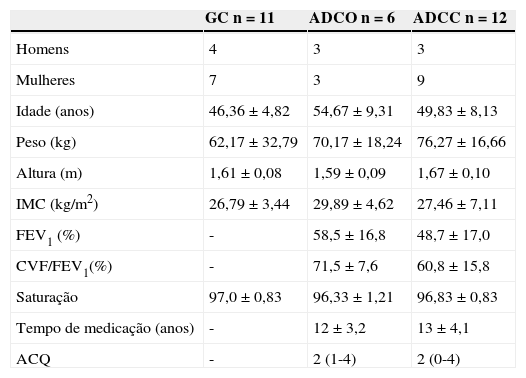
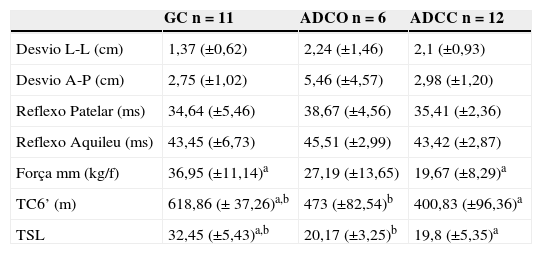
ResultadosInicialmente foram triados 40 indivíduos portadores de ADC, tendo sido 11 excluídos por não cumprirem os critérios de inclusão, três por apresentarem doenças respiratórias associadas, 4 por estarem hospitalizados e outros 4 por não comparecerem à avaliação, assim, o total da amostra com ADC foi composta de 18 indivíduos. Vinte e nove indivíduos participaram no estudo, distribuídos entre três grupos distintos: GC (n = 11), ADCC (n = 12) e ADCO (n = 6). Não houve diferenças estatisticamente significativas entre os grupos com relação à idade, peso, altura ou índice de massa corporal (p> 0,05), demonstrando a homogeneidade da amostra (tabela 1). Não houve diferenças estatisticamente significativas entre os grupos em relação aos aspetos neurofisiológicos (p>0,05). O GC diferiu significativamente de ambos os grupos com ADC no que diz respeito à capacidade funcional, atingindo maior número de repetições no teste senta-levanta e uma distância maior na prova da marcha dos 6 minutos. Em relação à força muscular, medida pela análise do músculo quadríceps, o GC só diferiu do grupo ADCC (tabela 2).
Características antropométricas da amostra do estudo
| GC n = 11 | ADCO n = 6 | ADCC n = 12 | |
|---|---|---|---|
| Homens | 4 | 3 | 3 |
| Mulheres | 7 | 3 | 9 |
| Idade (anos) | 46,36 ± 4,82 | 54,67 ± 9,31 | 49,83 ± 8,13 |
| Peso (kg) | 62,17 ± 32,79 | 70,17 ± 18,24 | 76,27 ± 16,66 |
| Altura (m) | 1,61 ± 0,08 | 1,59 ± 0,09 | 1,67 ± 0,10 |
| IMC (kg/m2) | 26,79 ± 3,44 | 29,89 ± 4,62 | 27,46 ± 7,11 |
| FEV1 (%) | - | 58,5 ± 16,8 | 48,7 ± 17,0 |
| CVF/FEV1(%) | - | 71,5 ± 7,6 | 60,8 ± 15,8 |
| Saturação | 97,0 ± 0,83 | 96,33 ± 1,21 | 96,83 ± 0,83 |
| Tempo de medicação (anos) | - | 12 ± 3,2 | 13 ± 4,1 |
| ACQ | - | 2 (1-4) | 2 (0-4) |
ADCC: asma de difícil controlo com uso de corticóide via oral; ADCO: asma de difícil controlo com uso de Omalizumab; ACQ: asthma control questionnaire; GC: grupo controlo; IMC: índice de massa corporal; One-Way Anova e post hoc de Tukey: * p < 0,05; VEMS: volume expiratório máximo no 1° segundo.
Dados médios e respetivos desvios padrão referentes às avaliações neurofisiológicas e da capacidade funcional
| GC n = 11 | ADCO n = 6 | ADCC n = 12 | |
|---|---|---|---|
| Desvio L-L (cm) | 1,37 (±0,62) | 2,24 (±1,46) | 2,1 (±0,93) |
| Desvio A-P (cm) | 2,75 (±1,02) | 5,46 (±4,57) | 2,98 (±1,20) |
| Reflexo Patelar (ms) | 34,64 (±5,46) | 38,67 (±4,56) | 35,41 (±2,36) |
| Reflexo Aquileu (ms) | 43,45 (±6,73) | 45,51 (±2,99) | 43,42 (±2,87) |
| Força mm (kg/f) | 36,95 (±11,14)a | 27,19 (±13,65) | 19,67 (±8,29)a |
| TC6’ (m) | 618,86 (± 37,26)a,b | 473 (±82,54)b | 400,83 (±96,36)a |
| TSL | 32,45 (±5,43)a,b | 20,17 (±3,25)b | 19,8 (±5,35)a |
ADCC: asma de difícil controlo com uso de corticóide via oral; ADCO: asma de difícil controlo com uso de Omalizumab; Desvio A-P: desvio antero-posterior; Desvio L-L: desvio latero-lateral; Força mm: força muscular do quadríceps; GC: grupo controlo; One-Way Anova e post hoc de Tukey: a diferença entre GC e ADCC (p < 0,05); b diferença entre GC e ADCO (p < 0,05); TC6’(m): prova da marcha dos 6 minutos em metros; TSL: teste senta-levanta (número de repetições).
Os resultados revelaram que o grupo que fez uso do corticóide oral (ADCC) teve o menor VEMS, alcançou a menor distância na prova da marcha dos 6 minutos e alcançou o menor número de repetições no teste senta-levanta, sugerindo assim fraqueza muscular, que foi confirmada pela avaliação da força muscular do quadríceps. No entanto, apesar de apresentarem maior gravidade da obstrução e menor capacidade funcional, o grupo ADCC foi semelhante aos grupos ADCO e GC no que diz respeito aos aspetos neurofisiológicos.
Não foi necessário oxigénio suplementar durante as avaliações, pois os pacientes não exibiram queda na SpO2 maior do que 4% do estado inicial ou sinais clínicos que indicavam a utilização de oxigênio, evitando assim a mascaramento dos resultados obtidos.
Não houve diferenças estatisticamente significativas entre os grupos em relação ao equilíbrio estático, avaliado pela oscilação do centro de pressão sobre uma plataforma de força. Também não houve diferenças estatisticamente significativas entre os grupos quanto ao tempo de latência nos reflexos patelar e de Aquiles. No entanto, em pacientes com doença pulmonar obstrutiva crónica (DPOC) foi encontrada deficiência motora, redução da resposta reflexa, fraqueza muscular e menor capacidade funcional em comparação com indivíduos saudáveis, provavelmente devido à deficiência sensorial-motora causada por hipoxemia16,25,26. Kayacan et al.26 reportaram alterações neurofisiológicas em 93,8% dos pacientes com DPOC e Jann et al.27 demonstraram uma ligeira redução na velocidade de condução nervosa e da amplitude do potencial de ação de unidades motoras em casos de insuficiência respiratória crónica, sugerindo a ocorrência de neuropatia periférica. Embora haja evidência de que pacientes com ADC podem apresentar limitações físicas, no presente estudo, não foram encontrado alterações neurofisiológicas nesses indivíduos.
Acerca da capacidade funcional, Ozalevli et al.23 compararam o teste senta-levanta com a prova da marcha dos 6 minutos e descobriram que o primeiro pode determinar a capacidade funcional, tanto quanto o último, porém com menos stress hemodinâmico em pacientes com doenças pulmonares. Segundo os autores, o teste senta-levanta correlaciona-se igualmente com a dispneia e a força muscular periférica, tendo o presente estudo corroborado esses achados.
A força muscular diferiu significativamente entre o ADCC e grupos de controlo, provavelmente devido ao facto de o uso contínuo de corticóides provocar miopatia15–18. Este achado não corrobora os resultados do estudo realizado por Bruin28, que constatou que pacientes asmáticos (leve e moderada) não demonstraram alterações na área de secção transversal durante o pico de força muscular gerada pelo quadríceps em comparação com indivíduos saudáveis. No entanto, Lim29 descreveu que o tratamento prolongado com corticosteróides resultou em fraqueza muscular importante do quadríceps e força muscular respiratória em pacientes com asma e DPOC.
Embora todos os pacientes com ADC tenham demonstrado redução da capacidade funcional, o grupo tratado com omalizumabe (ADCO) não exibiu redução na força muscular em comparação com o grupo controlo. Realce-se que pacientes em uso de omalizumabe não são suscetíveis aos diversos efeitos colaterais dos corticóides, tais como: problemas de pele, diabetes mellitus, hipertensão arterial sistémica, insuficiência cardíaca, osteoporose. Assim, pode-se inferir que os pacientes que fazem uso de omalizumabe parecem beneficiar mais. A desvantagem do omalizumabe é seu alto custo (cerca de 815 €/mês), mesmo sendo oferecido pelo sistema de saúde pública brasileiro, este medicamento não é disponibilizado tão facilmente e só é distribuído em centros específicos.
Apesar de não haver diferenças estatisticamente significantes entre os grupos em relação aos aspetos neurofisiológicos, todos os pacientes com ADC apresentaram redução da capacidade funcional em comparação ao grupo controlo (redução da força muscular, menor distância percorrida na prova da marcha dos 6 minutos e menos repetições no teste senta-levanta).
ConclusãoIndivíduos com ADC apresentaram redução na capacidade funcional. O grupo ADCC também demonstrou redução da força muscular quando comparado ao grupo controlo, provavelmente causado pelo uso contínuo de corticóides. No entanto, nenhuma alteração neurofisiológica foi encontrada na população estudada. Estes dados contribuem para melhor compreensão da condição física de tais pacientes e podem ser usados para melhorar os programas de reabilitação pulmonar para indivíduos com asma de difícil controlo.
Conflito de interessesOs autores declaram não haver conflito de interesses.