A pandemia por vírus influenza A (H1N1) 2009 (i.e., Pandemia de Gripe A) é uma doença infeciosa aguda causada pelo vírus influenza A (H1N1) 2009. Esta patologia apresenta sintomas respiratórios, gastrointestinais e sistémicos, tendo elevada incidência na idade pediátrica.
ObjetivoEstudar a epidemiologia, a abordagem e as complicações da Pandemia de Gripe A na população pediátrica de um hospital de nível iii em Lisboa, Portugal, entre Setembro e Dezembro de 2009.
Material e métodosEstudo retrospetivo dos processos das crianças que realizaram pesquisa do vírus influenza A (H1N1) 2009 por reverse transcriptase-polymerase chain reaction. Analisaram-se os seguintes parâmetros: número de testes, dia de doença, sexo, resultado, distribuição etária, sintomatologia, internamento e motivo para realização do teste. A distribuição e os resultados dos testes foram comparados com a atividade gripal da Pandemia de Gripe A em Portugal. Nos casos de infeção confirmada, estudaram-se também a necessidade de internamento, fatores de risco, gravidade, radiografia de tórax, tratamento e complicações.
ResultadosRealizaram-se 351 testes, em média 2,6 dias após o início dos sintomas, dos quais 71,8% em ambulatório e 30% em crianças com idade inferior a 3 anos. No total, 54,4% dos testes foram positivos para o vírus influenza A (H1N1) 2009 e as principais comorbilidades foram de natureza respiratória e cardiovascular. Cento e noventa e um casos foram confirmados laboratorialmente e 13,6% necessitaram de internamento, com duração média de 2,7 dias. Em 82,2% dos casos, a gravidade foi ligeira, constituindo a febre e a tosse a sintomatologia mais frequente, presente em 91,9% e 93,7% respetivamente. A terapêutica com o antiviral, oseltamivir, foi implementada em 35,6% dos casos. O oseltamivir foi utilizado em 12 crianças com idade inferior a um ano, incluindo uma com um mês de idade, sem registo de efeitos secundários.
DiscussãoOs dados epidemiológicos obtidos estão coformes com os estudos nacionais e internacionais publicados. A informação científica disponibilizada e as recomendações de Direção-Geral de Saúde contribuíram para a uniformização de condutas e evolução clínica favorável.
The 2009 pandemic influenza A (H1N1) (i.e., Pandemic Influenza) is an acute, infectious illness caused by the influenza A (H1N1) 2009 virus. This disease involves respiratory, gastrointestinal and systemic symptoms along with a high incidence occurring at a paediatric age.
ObjectiveTo study the epidemiology, approach and complications of Pandemic Influenza in the paediatric population of a third-level hospital in Lisbon, Portugal, between September and December 2009.
Materials and methodsA retrospective study of children who had received the influenza A (H1N1) 2009 virus test by real time reverse transcriptase-polymerase chain reaction (RT-PCR) were included. The following parameters were analysed: number of tests, days of illness, sex, outcome, age, symptoms, hospitalisation and reason for testing. The distribution and test results were compared with the Pandemic Influenza activity in Portugal. Moreover, among the confirmed cases of infection, the need for hospitalisation, risk factors, severity, chest radiography, treatment and complications were also examined.
ResultsA total of 351 tests were performed, on average, 2.6 days after initial symptoms, which included 71.8% outpatients and 30% children younger than three years of age. Overall, 54.4% of the tests were positive for the influenza A (H1N1) 2009 virus and the main comorbidities were respiratory and cardiovascular in nature. One hundred ninety-one cases were confirmed by laboratory studies, and 13.6% required hospitalisation, which lasted an average of 2.7 days. In 82.2% of the cases, the severity was mild, with fever and cough as the most frequent symptoms at 91.9% and 93.7%, respectively. Therapy with the antiviral drug, oseltamivir, was implemented in 35.6% of the cases. Additionally, oseltamivir was used in twelve infants younger than one year in age, including a one-month-old infant with no observed side effects.
DiscussionThe epidemiological data obtained are consistent with the published national and international studies. The scientific information available and the recommendations of the irectorate-General for Health contributed to the uniformity of the approaches and the successful outcome.
A pandemia por vírus influenza A (H1N1) 2009 (i.e., Pandemia de Gripe A) é uma doença infeciosa aguda causada pelo vírus influenza A (H1N1) 2009, e que apresenta sintomatologia respiratória, gastrointestinal e sistémica1. Comparativamente à gripe sazonal, a Pandemia de Gripe A teve uma taxa de incidência elevada entre crianças e adolescentes. Neste grupo etário, a maioria dos casos consistiu em formas ligeiras a moderadas da doença, embora tenham sido descritos casos graves e fatais1,2.
A infeção pelo vírus influenza A (H1N1) 2009 causa um largo espetro de síndromes clínicas, desde infeção respiratória alta sem febre até pneumonia viral fulminante1. Predominam os sintomas gripais típicos, nomeadamente febre, tosse, odinofagia, cefaleias, rinorreia e mialgias. A sintomatologia gastrointestinal (náuseas, vómitos e diarreia) também é frequente1,3–8.
Constituem fatores de risco para complicações e formas graves de doença as seguintes condições: idade inferior a 5 anos, gravidez, doença cardiovascular, doenças pulmonar crónica, renal e hepática, imunossupressão, obesidade grave (i.e., IMC > 25kg/m2 até aos 10 anos, IMC > 35 kg/m2 entre os 10 e os 18 anos de idade), hemoglobinopatia, doenças neuromuscular e metabólica1,3,9–11.
O diagnostico laboratorial pode ser efetuado por reverse transcriptase-polymerase chain reaction (RT-PCR) de amostras de secreções naso e/ou orofaríngeas. Este teste demonstrou sensibilidade elevada e poder ser realizado em tempo útil para decisão clínica1,3–6,11. O tratamento com oseltamivir, quando iniciado de forma precoce e criteriosa, pode melhorar o prognóstico, reduzindo a necessidade e duração da hospitalização, assim como a progressão para formas graves e fatais da doença1,3,12,13.
Em Portugal, a resposta à Pandemia de Gripe A foi organizada de acordo com o plano pandémico nacional da Direção-Geral de Saúde (DGS). Durante a Pandemia de Gripe A, a DGS estimou uma taxa de ataque de 10-15%, com o pico de incidência nas semanas 47 e 48 de 2009. Do total de casos notificados (n=192294), 0,6% necessitaram de internamento, e 0,1% foram admitidos numa unidade de cuidados intensivos (UCI). Durante a fase de mitigação, uma fase que começou no dia 21 de agosto de 2009 e que se focou no diagnóstico clínico, vigilância e/ou tratamento dos doentes10, 30% dos casos ocorreram em crianças com idade inferior a 10 anos. A taxa de mortalidade bruta foi de 1,17/100000 indivíduos, e das 124 mortes, 6 ocorreram em doentes com idade inferior a 15 anos10.
Os dados disponíveis sobre as características da doença, o tratamento com oseltamivir e a evolução da Pandemia de Gripe A em crianças, nomeadamente em Portugal, são limitados. Por conseguinte, é importante recolher e analisar de forma crítica a informação clínica disponível, que pode ser útil na avaliação do impacto e abordagem da Pandemia de Gripe A.
ObjetivosO objetivo deste estudo é analisar a epidemiologia, a abordagem e as complicações da Pandemia de Gripe A na população pediátrica de um hospital de nível iii em Lisboa, Portugal, entre Setembro e Dezembro de 2009, que representa o período de elevada atividade gripal pandémica.
Material e métodosFoi realizado um estudo retrospetivo dos processos das crianças admitidas no serviço de urgência de pediatria de um hospital de nível iii em Lisboa, Portugal, e que realizaram pesquisa do vírus influenza A (H1N1) 2009 por RT-PCR. Um hospital de nível iii (ou central) define-se como um hospital público com responsabilidades nacionais ou inter-regionais, que tem valências e recursos humanos e técnicos altamente diferenciados. Neste estudo, apenas um teste foi efetuado em cada criança. Analisaram-se os seguintes parâmetros: número de testes, dia de doença, resultado, sexo, distribuição etária, sintomas, internamento e motivo para a realização do teste. A distribuição e o resultado dos testes foram comparados com a atividade gripal pandémica em Portugal. Nos casos de infeção confirmados laboratorialmente, foram também analisados os seguintes parâmetros: tratamento, internamento, fatores de risco, gravidade (de acordo com os critérios estabelecidos nas recomendações oficiais da DGS)14, radiografia de tórax e complicações. Os dados foram colhidos a partir dos registos médicos informatizados do serviço de pediatria e dos formulários oficiais da DGS para requisição do teste15. A análise estatística foi realizada com o programa Microsoft Office Excel 2007®, utilizando os testes qui-quadrado e Mann-Whitney. O valor p inferior a 0,05 foi considerado estatisticamente significativo.
ResultadosPesquisa do vírus influenza A (H1N1) 2009 por RT-PCR na população pediátrica de um hospital de nível iii em Lisboa, Portugal
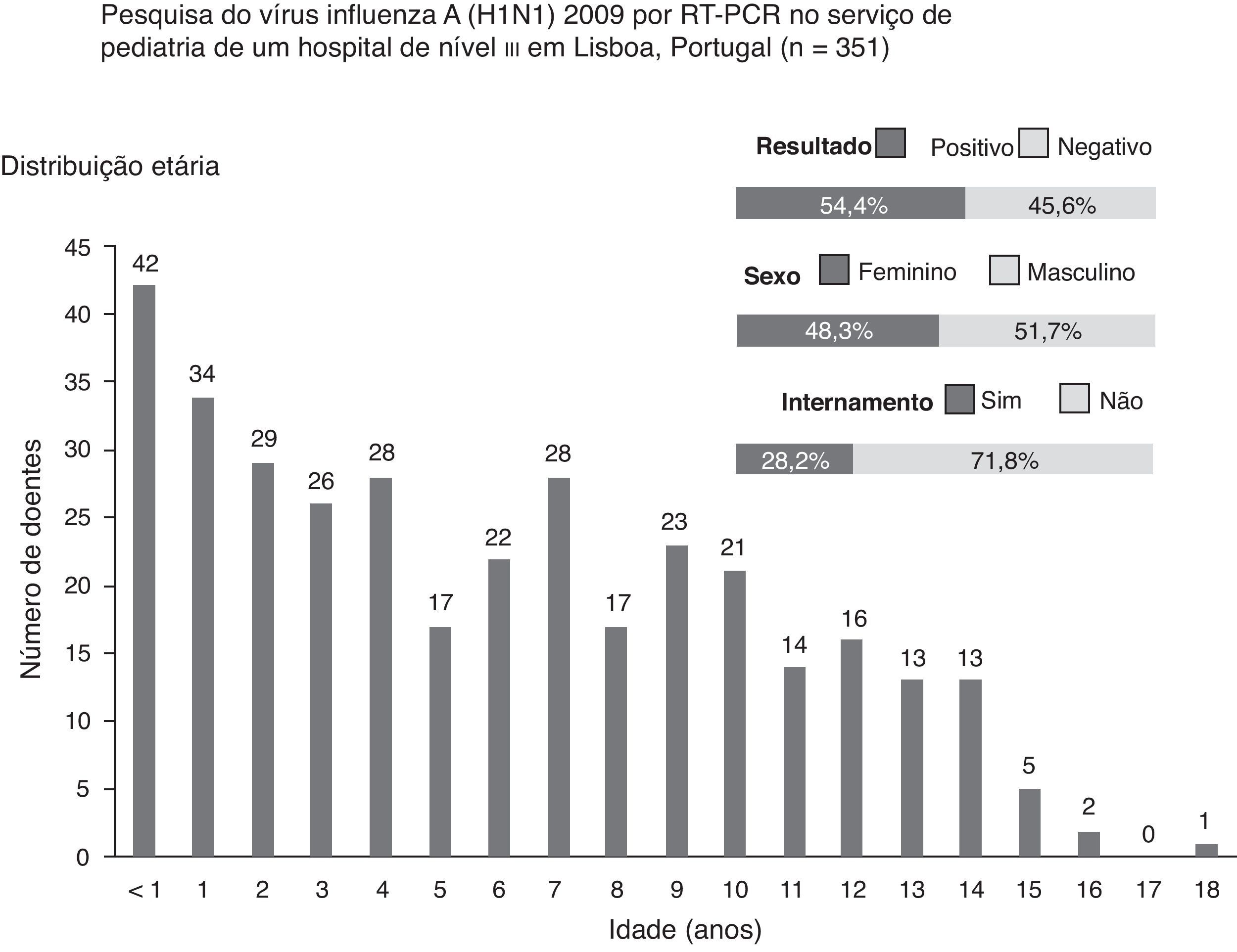
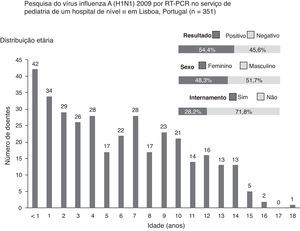
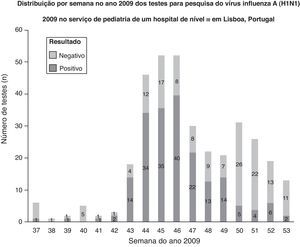
Durante período em que decorreu o estudo, foram realizados 351 testes, em média, 2,6 dias após o início dos sintomas. Destes doentes, 51,7% (n=181) eram do sexo masculino, e 54,4% (n=191) dos testes foram positivos. A mediana da idade foi de 5 anos (um mês a 18 anos), e 30% (n=105) dos indivíduos tinham idade inferior a 3 anos (fig. 1). Os sintomas mais frequentes foram febre (96,6%), tosse (87,7%), rinorreia (60,4%), odinofagia (40,5%), cefaleias (38,7%), vómitos (31,9%), mialgias (27,6%) e diarreia (18,8%)
Do total de testes, 71,8% (n=252) foram efetuados em ambulatório (fig. 1). Destes, 65,5% (n=165) foram positivos, e a maioria das crianças tinha síndrome gripal (92%). Efetuaram-se 99 testes em crianças internadas, e 26,3% (n=26) tiveram resultado positivo. Estes testes foram requisitados principalmente em doentes com pneumonia (29%) e bronquiolite aguda (25%). A diferença encontrada na positividade dos testes em ambulatório (65,5%) e em internamento (26,3%) foi estatisticamente significativa (p<0,01).
As principais indicações para realização do teste foram as seguintes: doença pulmonar crónica, nomeadamente asma e sibilância recorrente sob terapêutica diária com corticoterapia inalatória (n=58), doença cardiovascular (n=23), e imunossupressão (n=10). Os principais motivos relacionados com os contactos (i.e., um indivíduo que esteve suficientemente próximo de uma pessoa infetada para ter sido exposta a material infecioso) foram a gravidez (n=44) e crianças com idade inferior a 12 meses (n=30). Em alguns casos existia mais de um motivo para a realização do teste.
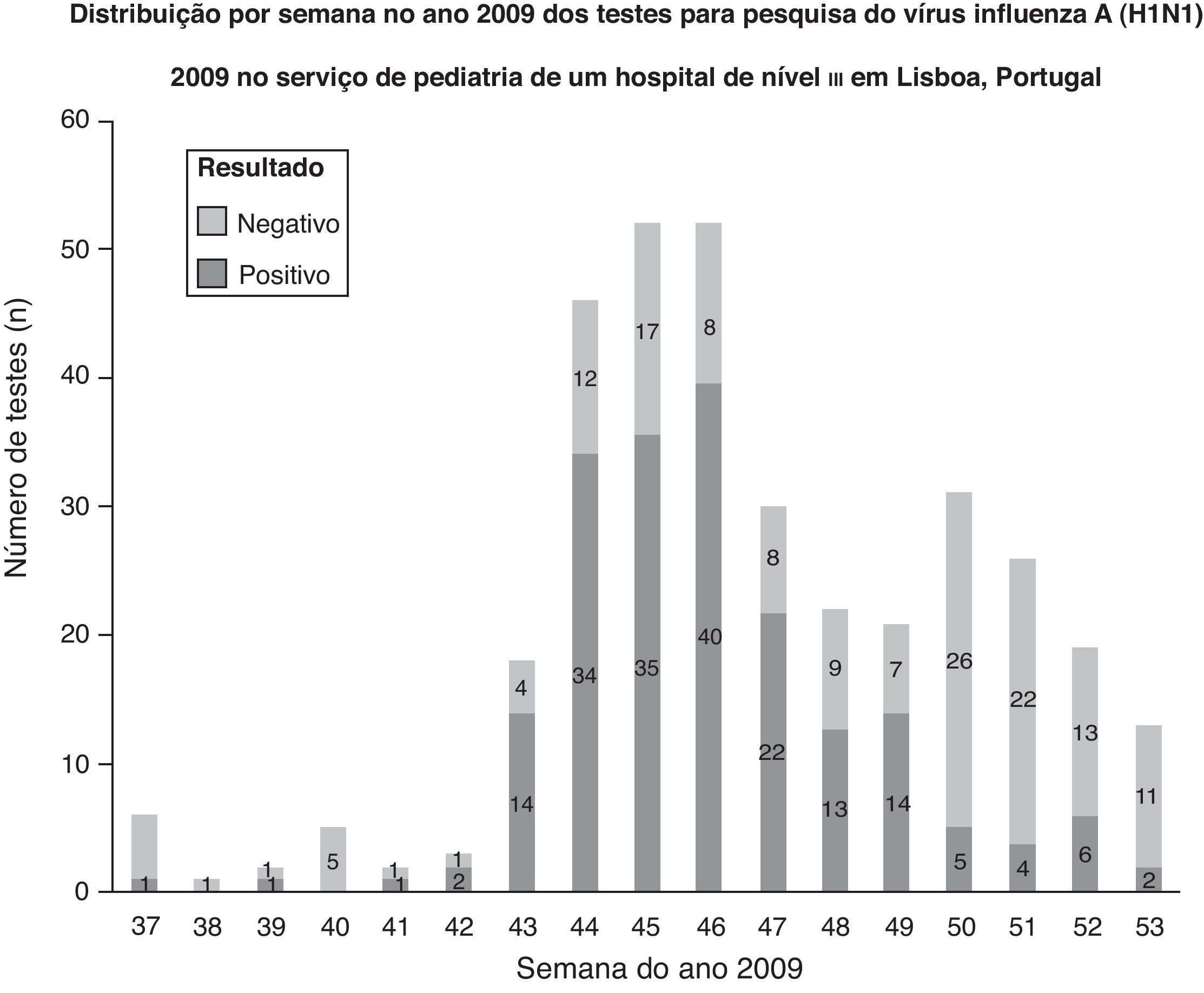
Tendo em conta a atividade gripal pandémica em Portugal em 2009, durante o pico de atividade, foram requisitados um maior número de testes, e a maioria dos resultados foi positiva. Quando a atividade gripal pandémica decresceu, a maioria dos testes foi negativa (fig. 2). Casos de infeção pelo vírus influenza A (H1N1) 2009 confirmados laboratorialmente na população pediátrica de um hospital de nível iii em Lisboa, Portugal.
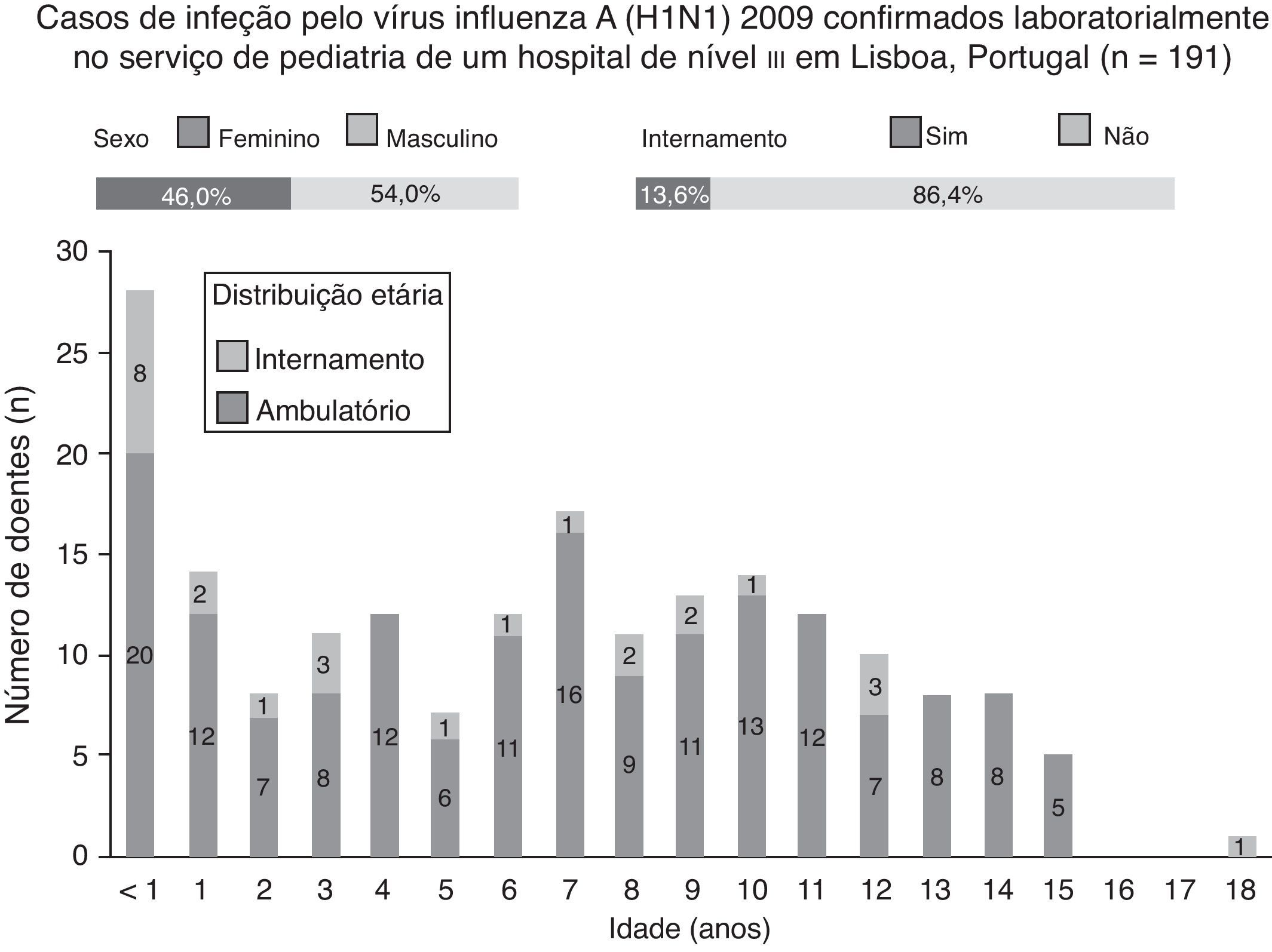
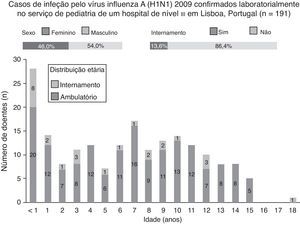
Durante o estudo, 191 casos de infeção pelo vírus influenza A (H1N1) 2009 foram confirmados laboratorialmente, dos quais 54,0% (n=103) eram do sexo masculino, 13,6% (n=26) necessitaram de internamento e 22% (n=42) tinham menos de 2 anos de idade (fig. 3). Do total de casos confirmados, a mediana da idade foi de 7 anos (um mês a 18 anos). Em ambulatório, a mediana da idade foi de 7 anos (6 meses a 15 anos) e em internamento foi de 3 anos (um mês a 18 anos); esta diferença foi estatisticamente significativa (p<0,05).
Em crianças com infeção pelo vírus influenza A (H1N1) 2009, os sintomas mais frequentes foram febre (97,9%), tosse (93,7%), rinorreia (57,6%), cefaleias (55,0%), odinofagia (49,2%) e mialgias (37,7%). Além disso, tosse, odinofagia, cefaleias e mialgias ocorreram mais frequentemente nos casos confirmados (p<0,01). Febre, rinorreia e sintomas gastrointestinais (i.e., vómitos (32,5%), diarreia (15,2%) e náuseas (9,9%)) também foram mais frequentes, mas a diferença entre os casos positivos e negativos não foi estatisticamente significativa.
Idade inferior a 2 anos (n=50), asma e sibilância recorrente (n=25) e doença cardiovascular (n=15) constituíram os fatores de risco mais frequentes entre os casos confirmados.
A gravidade da doença foi ligeira em 82,2% (n=157) dos casos, e os restantes consistiram em formas moderadas. Não foram reportados casos graves. Em ambulatório, predominaram formas ligeiras de doença (89,0%), e em internamento formas moderadas (61,5%). Dos 191 casos confirmados laboratorialmente, foi instituída terapêutica com oseltamivir em 35,6% (n=68), com efeitos secundários, nomeadamente vómitos, em 5,9% (n=4). Este antiviral foi administrado em 28,6% (n=47) das crianças tratadas em ambulatório e em 80,8% (n=21) das internadas; esta diferença foi estatisticamente significativa (p<0,01). Todas as crianças internadas que foram medicadas com oseltamivir (n=21), iniciaram terapêutica nas primeiras 24 horas de internamento, e 71,4% (n=15) fizeram-no nas primeiras 48 horas de doença. Doze crianças com idade inferior a um ano (17,6%), incluindo uma com um mês de idade, foram tratadas com oseltamivir, sem registo de quaisquer efeitos secundários.
Das 26 crianças internadas, 65,4% (n=17) fizeram uma radiografia de tórax à entrada. Destas, 42,3% (n=7) tinham um padrão radiológico de pneumonia intersticial bilateral. A duração média da hospitalização foi de 2,7 dias (um a 12 dias), e uma criança teve um derrame pericárdico ligeiro que resolveu sem sequelas.
DiscussãoO teste de pesquisa de vírus influenza A (H1N1) 2009 por RT-PCR demonstrou utilidade na prática clínica, e na maioria dos casos, forneceu resultados em tempo útil para a tomada de decisões clínicas16. O teste foi realizado, em média, 2,6 dias após o início da sintomatologia, refletindo a consciencialização pública da Pandemia de Gripe A e o recurso precoce aos serviços de saúde. Este aspeto permitiu a colheita de amostras numa fase inicial da doença, considerada a altura ideal para a identificação do vírus e melhoria da abordagem terapêutica17,18. Os autores consideram necessária a realização de estudos para avaliar o recurso aos serviços de saúde e o custo-eficácia das estratégias de saúde implementadas durante a Pandemia de Gripe A. Tendo em conta a atividade da Pandemia de Gripe A em Portugal em 2009, durante o pico de atividade gripal, foram requisitados um número elevado de testes, e a maioria dos resultados foi positiva. Este facto pode refletir a predominância do vírus influenza A (H1N1) 2009 durante o período do estudo. Quando a atividade gripal pandémica decresceu, a maioria dos resultados foi negativa. Outros estudos são necessários para compreender se outros agentes infeciosos, como o vírus sincicial respiratório, aumentaram quando a atividade gripal pandémica decresceu.
Duas razões principais podem explicar a diferença entre testes positivos em ambulatório (65,5%) e em internamento (26,3%). Primeiro, foi necessário excluir infeção pelo vírus influenza A (H1N1) 2009 em crianças internadas com infeção respiratória, não apenas para implementar medidas de controlo de infeção, mas também para determinar a necessidade de intervenção terapêutica nos casos positivos3,4. Segundo, as formas atípicas da doença descritas em crianças, por exemplo sem febre, não foram negligenciadas em doentes internados3,5.
Refletindo as diretrizes da DGS, assim como os fatores de risco descritos, o nosso estudo revelou que a sibilância recorrente, a asma, a doença cardiovascular, a imunossupressão, a gravidez de um contacto e a idade inferior a 5 anos foram as principais razões para realizar o teste. Além disso, cerca de um terço dos testes foram efetuados em crianças com idade inferior a 3 anos1,3,9–11.
De acordo com a literatura, a maioria dos casos de infeção pelo vírus influenza A (H1N1) 2009 consiste em formas ligeiras a moderadas e autolimitadas de doença, pelo que é compreensível que a maioria não necessite de internamento (86,4%)19.
Em ambulatório, a mediana da idade foi de 7 anos, e predominaram as formas ligeiras de doença. Em contraste, as crianças internadas tinham uma mediana de 3 anos de idade e as formas moderadas foram mais prevalentes. A diferença na gravidade e idade das crianças tratadas em ambulatório e em internamento foi estatisticamente significativa. A idade inferior a 5 anos e a noção clínica de gravidade foram os principais determinantes de internamento, o que está de acordo com os dados descritos em outras séries4,9,10,20,21.
Os sintomas gripais, incluindo febre, tosse, rinorreia, cefaleias e odinofagia, foram os mais frequentes. Atendendo ao grupo etário envolvido, é compreensível que mialgias e artralgias não constituam queixas tão frequentes como em adultos, possivelmente devido à dificuldade das crianças em descrever esses sintomas aos cuidadores. A percentagem de crianças com infeção pelo vírus influenza A (H1N1) 2009 que desenvolveram sintomas gastrointestinais não foi estatisticamente significativa; no entanto, a percentagem de vómitos (32,5%), diarreia (15,2%) e náuseas (9,9%) são consistentes com os dados descritos noutras publicações1,19.
A terapêutica com oseltamivir foi administrada em 35,6% dos casos confirmados, o que é comparável aos dados disponibilizados pela DGS para Portugal (32%)10. Este antiviral demonstrou ser seguro, e os vómitos verificados em apenas 5,9% dos indivíduos, não implicaram a descontinuação do tratamento em nenhum dos casos. O oseltamivir foi utilizado em 12 crianças com idade inferior a um ano, incluindo uma com um mês de idade, sem registo de quaisquer efeitos secundários. As recomendações para prevenção de alguns efeitos secundários, como a administração do antiviral com alimentos, podem ter contribuído para a taxa verificada3. A segurança e eficácia da terapêutica antiviral, em termos de progressão da doença, devem ser confirmadas em estudos controlados e aleatorizados.
A percentagem de crianças que fez oseltamivir foi superior em internamento (80,8%) comparativamente às tratadas em ambulatório (28,6%); p<0,01. Estes dados refletem a predominância de formas moderadas de doença entre as crianças internadas, assim como o facto de não iniciar ou iniciar oseltamivir após as 48-72 horas poder comprometer o prognóstico13. A administração de oseltamivir nas primeiras 48 horas de doença, verificado em 71,4% das crianças hospitalizadas neste estudo, pode ter contribuído para melhorar o prognóstico. As vantagens descritas para este fármaco, particularmente na redução da duração do internamento e progressão para formas graves da doença, podem ter contribuído para a duração média do internamento (2,7 dias), que foi inferior à média verificada em Portugal (DGS – 4,6 dias) e noutros estudos1,3,9,19,20.
As 5 crianças hospitalizadas que não receberam oseltamivir, foram internadas no contexto de vómitos incoercíveis, sem outros sintomas ou sinais de gravidade. Estas crianças ficaram assintomáticas e tiveram alta clínica 24 horas após a admissão.
As alterações encontradas na radiografia de tórax eram inespecíficas e similares às encontradas noutras infeções virais, não permitindo inferir a etiologia4,20.
O desenlace clínico foi favorável em todos os casos, incluindo na criança que apresentou um derrame pericárdico ligeiro, que resolveu espontaneamente e sem sequelas. Esta complicação encontra-se descrita na literatura3. Não houve complicações respiratórias graves nem necessidade de internamento numa UCI.
O serviço de pediatria seguiu as diretrizes de diagnóstico, vigilância e tratamento da Pandemia de Gripe A publicadas pela Direção-Geral de Saúde.
O nosso estudo tem algumas limitações. O estudo apresenta uma amostra pequena, correspondendo a apenas um hospital de Lisboa, Portugal; portanto, estes resultados não podem ser generalizados a outras populações pediátricas ou a outras áreas geográficas. A análise dos casos confirmados laboratorialmente certamente subestimou o total de casos de Pandemia de Gripe A que ocorreram durante o período em que decorreu o estudo. Não avaliámos nem comparámos o curso clínico das crianças tratadas com oseltamivir com aquelas que não fizeram o antiviral.
ConclusãoGlobalmente, os dados epidemiológicos obtidos e a abordagem da doença foram consistentes com outros estudos nacionais e internacionais publicados. A informação científica disponibilizada e as recomendações de Direção-Geral de Saúde contribuíram para a uniformização de condutas e evolução clínica favorável dos casos reportados na população do nosso estudo.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Os autores agradecem aos profissionais de saúde do serviço de patologia clínica e do serviço de pediatria do Hospital de São Francisco Xavier.